Ну и какая же тут связь? – спросите вы. Я бы сам, наверное, сказал, что никакой, если бы не одно «сладкое» обстоятельство.
 Наверное, каждый из нас обращал внимание на то, каким разным он – мёд – может быть. Я не говорю сейчас о подделках – только о настоящем мёде. Один – ароматный, прозрачный и однородный, другой – как густой, медленно текучий и непрозрачный гель с мелкими пупырышками, а третий – твердыня, которую и ложкой-то с трудом возьмёшь! Почему же налицо такие различия? Всё зависит от того, насколько закристаллизовался мёд и насколько он свежий, как долго стоял и как хранился – ответите вы. Да, всё это верно, и основное отличие у названных вариантов мёда в количестве и размере кристаллов в нём, которое очень хорошо ощущается при его дегустации. (Кстати, в мёде содержится смесь углеводов глюкозы и фруктозы и первой образует кристаллы глюкоза). Но почему два разных сорта мёда, собранные в одно и то же время и хранящиеся в абсолютно одинаковых условиях, имеют совершенно разного размера кристаллы после кристаллизации даже если соотношение глюкозы, фруктозы и воды в них одинаковое? Оказывается, всё дело тут в том свойстве веществ и, в частности, жидкости, которое называется поверхностным натяжением. Ведь кристаллы в мёде появляются из жидкого насыщенного раствора!
Наверное, каждый из нас обращал внимание на то, каким разным он – мёд – может быть. Я не говорю сейчас о подделках – только о настоящем мёде. Один – ароматный, прозрачный и однородный, другой – как густой, медленно текучий и непрозрачный гель с мелкими пупырышками, а третий – твердыня, которую и ложкой-то с трудом возьмёшь! Почему же налицо такие различия? Всё зависит от того, насколько закристаллизовался мёд и насколько он свежий, как долго стоял и как хранился – ответите вы. Да, всё это верно, и основное отличие у названных вариантов мёда в количестве и размере кристаллов в нём, которое очень хорошо ощущается при его дегустации. (Кстати, в мёде содержится смесь углеводов глюкозы и фруктозы и первой образует кристаллы глюкоза). Но почему два разных сорта мёда, собранные в одно и то же время и хранящиеся в абсолютно одинаковых условиях, имеют совершенно разного размера кристаллы после кристаллизации даже если соотношение глюкозы, фруктозы и воды в них одинаковое? Оказывается, всё дело тут в том свойстве веществ и, в частности, жидкости, которое называется поверхностным натяжением. Ведь кристаллы в мёде появляются из жидкого насыщенного раствора!
Что же такое поверхностное натяжение? Это та энергия, которую необходимо затратить (при постоянной температуре), чтобы увеличить площадь поверхности жидкости на один квадратный метр. Звучит более чем абстрактно, но если мы обратимся к конкретному примеру, всё станет предельно ясным.
Если вы возьмёте два вещества – 1 мл воды и 1 мл ртути (не забывайте, что пары ртути очень ядовиты и опыты с ней без наличия средств защиты и вне специально предназначенных для этого лабораторных помещений проводить нельзя!) и попытаетесь равномерно размазать их по поверхности двух одинаковых пластмассовых столиков площадью 1м2 каждый, то понятие «количество энергии» для вас приобретёт вполне конкретный смысл. Если в случае воды вам, возможно, удастся более-менее успешно распределить воду (но уж никак не сплошным слоем!), то на распределение ртути вы тщетно можете потратить целый день и море той самой «энергии», не получив почти никакого положительного результата! Ртуть будет собираться в шарики, кататься по поверхности, падать на пол и безжалостно издеваться над вами. Шариков станет немного большее количество, да и только! А всё дело тут именно в том, что поверхностное натяжение ртути (0,4865 Дж/м2) больше поверхностного натяжения воды (0,07286 Дж/м2) в 6,7 раза! Соответственно, вам пришлось бы потратить в 6,7 раза больше энергии, чтобы площадь поверхности ртути на столике соответствовала площади поверхности воды (правда, она всё-равно бы осталась при этом в виде шариков и не размазалась бы по столу!).
От чего зависит величина поверхностного натяжения?
- От специфических веществ, способных при растворении в жидкостиуменьшать её поверхностное натяжение. Эти вещества называются поверхностно-активными веществами или, сокращённо,ПАВ. С ними мы очень хорошо знакомы на практике на примере
 разнообразных моющих средств, мыла, шампуней, порошков и. т. п. Все перечисленные продукты содержат ПАВ. Надувая, например, мыльные пузыри, мы также всегда имеем дело с ПАВ и, уменьшенным за счёт их присутствия, поверхностным натяжением плёнки воды. (ПАВ отличаются специфическим строением, называемым амфифильным, при котором между собой химически связаны гидрофильная и гидрофобная части молекулы). Но одни ли специфические вещества снижают поверхностное натяжение?
разнообразных моющих средств, мыла, шампуней, порошков и. т. п. Все перечисленные продукты содержат ПАВ. Надувая, например, мыльные пузыри, мы также всегда имеем дело с ПАВ и, уменьшенным за счёт их присутствия, поверхностным натяжением плёнки воды. (ПАВ отличаются специфическим строением, называемым амфифильным, при котором между собой химически связаны гидрофильная и гидрофобная части молекулы). Но одни ли специфические вещества снижают поверхностное натяжение? - Само собой разумеется, от температуры (с повышением температуры поверхностное натяжение уменьшается),
- От концентрации и природы растворённого вещества,
- От природы растворителя.
- Казалось бы всё? Но не тут-то было! Ещё один ответ даёт самое обыкновенное, сотни раз наблюдаемое нами и всем известное природное явление, такое как дождь во время грозы. А чем он, собственно, примечателен? Обратите внимание, что дождь во время настоящей грозы (если туча висит прямо над вами) начинается, как правило, только после удара молнии. При этом саму молнию мы можем и не увидеть, но гром от неё всем прекрасно слышен! Закономерность тут предельно простая: микроскопические витающие капли воды, накопленные тучей, не могут слиться друг с другом, так как им мешает накопленный одноимённый заряд, благодаря которому они электрически отталкиваются друг от друга. После разряда молнии, когда капли теряют заряд, им уже ничто не мешает слиться друг с другом и они выпадают дождём на землю. При чём же тут поверхностное натяжение? А при том, что стабильность огромной поверхности микрокапель в грозовой туче, поддерживалась за счёт электрической энергии накопленного заряда (после укрупнения капель общая их поверхность резко уменьшилась) и, унесённая с молнией энергия, – это, по большей части, и есть энергия исчезнувшей избыточной поверхности, перешедшая в энергию света, тепла и ударных звуковых волн! А что же микрокапли в тучах? Заряд, находящийся на поверхности жидкости, оказывается, никогда незамеченным для неё не остаётся. Одноимённые заряды, находясь на поверхности любой капли, естественным образом отталкиваются и, этим самым, уменьшают поверхностное натяжение жидкости. Ну наконец-то, вот оно! Именно этот эффект позволяет наблюдать совершенно уникальное и очень красивое явление – несмешиваемость воды с водой! Я вовсе не оговорился! Об этом можно прочитать здесь.
Но вернёмся к нашему мёду. Пусть он закристаллизовался не полностью, а только частично и сироп заполняет пространство между кристаллами. Так какое же отношение к размеру кристаллов в мёде играет поверхностное натяжение? Между площадью поверхности остатков жидкого сиропа в мёде, находящегося в пространстве между кристаллами, и площадью поверхности всех образовавшихся в нём кристаллов существует, при оговоренных условиях, почти строгое равенство. Чем больше размеры кристаллов в мёде, тем меньше общая площадь границы между жидкостью и твёрдыми кристаллами. Ну и что? – скажете вы. А то, что поверхностное натяжение одного и второго, из двух разных, взятых нами выше, сортов мёда с самого начала было разным! В том мёде, в котором кристаллы получились меньше и он вышел более однородным, пастообразным и приятным на вкус, поверхностное натяжение исходного сиропа было меньше, чем у того мёда, в котором появились крупные кристаллы! А почему так? Ведь количество воды, глюкозы и фруктозы в обоих случаях было одинаковым. Всё так, однако, вспомним, что кроме этих компонентов мёд содержит огромное количество других органических веществ. Значит, все различия (и вкуса, и поверхностного натяжения, и размеров кристаллов) определяются именно этими органическими веществами! Среди всех этих прочих веществ существуют и такие, которые вполне определённо влияют на поверхностное натяжение – уменьшают его, а, значит, служат природными поверхностно-активными веществами. Первый наш сорт мёда содержал больше таких веществ, потому он и вышел более мелкокристалличным.
Такая долгая моя прелюдия с поверхностным натяжением, как вы, думаю, уже догадались, была совсем неслучайной! Но какое отношение имеет эпопея с 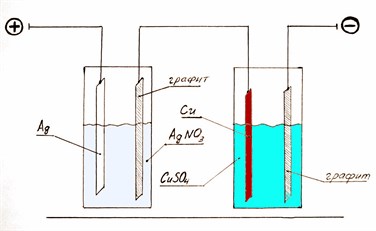 мёдом, поверхностным натяжением и зарядом к получению металла из раствора? Что за каша?! – спросите вы. Как оказалось, отношение есть – и самое прямое! Если вы возьмёте два раствора со средней концентрацией растворённого вещества – раствор нитрата серебра (в одном стакане) и раствор сульфата меди (в другом стакане) – и опустите в них одинаковые пластины серебра и меди (соответственно) в качестве анодов, а также графитовые одинаковые пластины в качестве катодов, то получите два небольших электролизёра. Соединив их последовательно по току, пропустим через них некоторое количество электричества. Количество электричества, прошедшее через каждый электролизёр будет, соответственно, одинаковым. Проведя серию простых экспериментов, изменяя значение тока в электролизёрах, вы очень скоро заметите, что на катодной поверхности (катод – отрицательно зараженный электрод) довольно легко получить относительно ровный слой осаждённой меди, а вот в случае с осаждением серебра – ничего у вас не выйдет. Вместо ровного слоя серебра вы получите много бесформенных, неравномерно расположенных дендритообразных кристалликов в виде ветвящихся нитей. Теперь вы видите связь с мёдом? Именно так! Как у нашего мёда в одном случае росли мелкие кристаллы, а в другом – крупные, так и в случае электролиза – кристаллики меди оказались относительно мелкими, а вот кристаллики серебра – существенно больше, почему и не вышло ровного слоя серебра! Как мёд со временем естественно кристаллизуется, так же кристаллизуется при электровыделении из раствора и металл! Процесс выделения металла в виде некоторого плотного осадка на катоде, при пропускании электрического тока через раствор, называется электрокристаллизацией. И закономерности, наблюдаемые при этом, в значительной степени, аналогичны закономерностям обычной кристаллизации! Значит, поверхностное натяжение на поверхности металл-раствор, в нашей попытке осадить серебро из раствора его нитрата, было слишком большим для формирования мелкокристаллического осадка? Точно так! Поэтому ничего и не получилось! (На самом деле закономерность несколько сложнее и сильно зависит от природы металла и величины характерного катодного перенапряжения). Но мы-то теперь знаем, каким образом изменять поверхностное натяжение раствора. Можно, к примеру, ввести ПАВ, изменить состав раствора (концентрацию и тип растворённого вещества), изменить температуру, но самое замечательное в том, что мы можем изменять величину (и знак) заряда поверхности металла, изменяя при этом поверхностное натяжение прилегающего раствора на катоде, путём простого изменения величины электрического тока, протекающего через электролизёр! Это даёт нам потрясающий ключ к управлению электрохимическими процессами на электродах! Все перечисленные ухищрения с успехом используются в современной технологии электрохимического осаждения металлов.
мёдом, поверхностным натяжением и зарядом к получению металла из раствора? Что за каша?! – спросите вы. Как оказалось, отношение есть – и самое прямое! Если вы возьмёте два раствора со средней концентрацией растворённого вещества – раствор нитрата серебра (в одном стакане) и раствор сульфата меди (в другом стакане) – и опустите в них одинаковые пластины серебра и меди (соответственно) в качестве анодов, а также графитовые одинаковые пластины в качестве катодов, то получите два небольших электролизёра. Соединив их последовательно по току, пропустим через них некоторое количество электричества. Количество электричества, прошедшее через каждый электролизёр будет, соответственно, одинаковым. Проведя серию простых экспериментов, изменяя значение тока в электролизёрах, вы очень скоро заметите, что на катодной поверхности (катод – отрицательно зараженный электрод) довольно легко получить относительно ровный слой осаждённой меди, а вот в случае с осаждением серебра – ничего у вас не выйдет. Вместо ровного слоя серебра вы получите много бесформенных, неравномерно расположенных дендритообразных кристалликов в виде ветвящихся нитей. Теперь вы видите связь с мёдом? Именно так! Как у нашего мёда в одном случае росли мелкие кристаллы, а в другом – крупные, так и в случае электролиза – кристаллики меди оказались относительно мелкими, а вот кристаллики серебра – существенно больше, почему и не вышло ровного слоя серебра! Как мёд со временем естественно кристаллизуется, так же кристаллизуется при электровыделении из раствора и металл! Процесс выделения металла в виде некоторого плотного осадка на катоде, при пропускании электрического тока через раствор, называется электрокристаллизацией. И закономерности, наблюдаемые при этом, в значительной степени, аналогичны закономерностям обычной кристаллизации! Значит, поверхностное натяжение на поверхности металл-раствор, в нашей попытке осадить серебро из раствора его нитрата, было слишком большим для формирования мелкокристаллического осадка? Точно так! Поэтому ничего и не получилось! (На самом деле закономерность несколько сложнее и сильно зависит от природы металла и величины характерного катодного перенапряжения). Но мы-то теперь знаем, каким образом изменять поверхностное натяжение раствора. Можно, к примеру, ввести ПАВ, изменить состав раствора (концентрацию и тип растворённого вещества), изменить температуру, но самое замечательное в том, что мы можем изменять величину (и знак) заряда поверхности металла, изменяя при этом поверхностное натяжение прилегающего раствора на катоде, путём простого изменения величины электрического тока, протекающего через электролизёр! Это даёт нам потрясающий ключ к управлению электрохимическими процессами на электродах! Все перечисленные ухищрения с успехом используются в современной технологии электрохимического осаждения металлов.
Для тех же читателей, которых мне удалось заинтриговать конкретным примером с серебром, привожу состав раствора, применив который, у вас всё получится! Теперь, зная многое, я думаю, вы и сами сможете проанализировать то, почему раствор именно такой, какой есть, и какую конкретно функцию в нём выполняет каждый компонент. Желаю удачи!
Состав электролита:
1) Дицианоаргентат калия K[Ag(CN)2] – 75-90 г/л
2) Роданид калия (KSCN) – 200-250 г/л
3) Карбонат калия (K2CO3) – 20-40г/л
Режим осаждения:
Аноды – серебро, t = 18-30⁰С
Отношение площадей анода к катоду – 2 : 1
Катодная плотность тока 1-2 А/дм2
 Наверное, каждый из нас обращал внимание на то, каким разным он – мёд – может быть. Я не говорю сейчас о подделках – только о настоящем мёде. Один – ароматный, прозрачный и однородный, другой – как густой, медленно текучий и непрозрачный гель с мелкими пупырышками, а третий – твердыня, которую и ложкой-то с трудом возьмёшь! Почему же налицо такие различия? Всё зависит от того, насколько закристаллизовался мёд и насколько он свежий, как долго стоял и как хранился – ответите вы. Да, всё это верно, и основное отличие у названных вариантов мёда в количестве и размере кристаллов в нём, которое очень хорошо ощущается при его дегустации. (Кстати, в мёде содержится смесь углеводов глюкозы и фруктозы и первой образует кристаллы глюкоза). Но почему два разных сорта мёда, собранные в одно и то же время и хранящиеся в абсолютно одинаковых условиях, имеют совершенно разного размера кристаллы после кристаллизации даже если соотношение глюкозы, фруктозы и воды в них одинаковое? Оказывается, всё дело тут в том свойстве веществ и, в частности, жидкости, которое называется поверхностным натяжением. Ведь кристаллы в мёде появляются из жидкого насыщенного раствора!
Наверное, каждый из нас обращал внимание на то, каким разным он – мёд – может быть. Я не говорю сейчас о подделках – только о настоящем мёде. Один – ароматный, прозрачный и однородный, другой – как густой, медленно текучий и непрозрачный гель с мелкими пупырышками, а третий – твердыня, которую и ложкой-то с трудом возьмёшь! Почему же налицо такие различия? Всё зависит от того, насколько закристаллизовался мёд и насколько он свежий, как долго стоял и как хранился – ответите вы. Да, всё это верно, и основное отличие у названных вариантов мёда в количестве и размере кристаллов в нём, которое очень хорошо ощущается при его дегустации. (Кстати, в мёде содержится смесь углеводов глюкозы и фруктозы и первой образует кристаллы глюкоза). Но почему два разных сорта мёда, собранные в одно и то же время и хранящиеся в абсолютно одинаковых условиях, имеют совершенно разного размера кристаллы после кристаллизации даже если соотношение глюкозы, фруктозы и воды в них одинаковое? Оказывается, всё дело тут в том свойстве веществ и, в частности, жидкости, которое называется поверхностным натяжением. Ведь кристаллы в мёде появляются из жидкого насыщенного раствора! разнообразных моющих средств, мыла, шампуней, порошков и. т. п. Все перечисленные продукты содержат ПАВ. Надувая, например, мыльные пузыри, мы также всегда имеем дело с ПАВ и, уменьшенным за счёт их присутствия, поверхностным натяжением плёнки воды. (ПАВ отличаются специфическим строением, называемым амфифильным, при котором между собой химически связаны гидрофильная и гидрофобная части молекулы). Но одни ли специфические вещества снижают поверхностное натяжение?
разнообразных моющих средств, мыла, шампуней, порошков и. т. п. Все перечисленные продукты содержат ПАВ. Надувая, например, мыльные пузыри, мы также всегда имеем дело с ПАВ и, уменьшенным за счёт их присутствия, поверхностным натяжением плёнки воды. (ПАВ отличаются специфическим строением, называемым амфифильным, при котором между собой химически связаны гидрофильная и гидрофобная части молекулы). Но одни ли специфические вещества снижают поверхностное натяжение? мёдом, поверхностным натяжением и зарядом к получению металла из раствора? Что за каша?! – спросите вы. Как оказалось, отношение есть – и самое прямое! Если вы возьмёте два раствора со средней концентрацией растворённого вещества – раствор нитрата серебра (в одном стакане) и раствор сульфата меди (в другом стакане) – и опустите в них одинаковые пластины серебра и меди (соответственно) в качестве анодов, а также графитовые одинаковые пластины в качестве катодов, то получите два небольших электролизёра. Соединив их последовательно по току, пропустим через них некоторое количество электричества. Количество электричества, прошедшее через каждый электролизёр будет, соответственно, одинаковым. Проведя серию простых экспериментов, изменяя значение тока в электролизёрах, вы очень скоро заметите, что на катодной поверхности (катод – отрицательно зараженный электрод) довольно легко получить относительно ровный слой осаждённой меди, а вот в случае с осаждением серебра – ничего у вас не выйдет. Вместо ровного слоя серебра вы получите много бесформенных, неравномерно расположенных дендритообразных кристалликов в виде ветвящихся нитей. Теперь вы видите связь с мёдом? Именно так! Как у нашего мёда в одном случае росли мелкие кристаллы, а в другом – крупные, так и в случае электролиза – кристаллики меди оказались относительно мелкими, а вот кристаллики серебра – существенно больше, почему и не вышло ровного слоя серебра! Как мёд со временем естественно кристаллизуется, так же кристаллизуется при электровыделении из раствора и металл! Процесс выделения металла в виде некоторого плотного осадка на катоде, при пропускании электрического тока через раствор, называется электрокристаллизацией. И закономерности, наблюдаемые при этом, в значительной степени, аналогичны закономерностям обычной кристаллизации! Значит, поверхностное натяжение на поверхности металл-раствор, в нашей попытке осадить серебро из раствора его нитрата, было слишком большим для формирования мелкокристаллического осадка? Точно так! Поэтому ничего и не получилось! (На самом деле закономерность несколько сложнее и сильно зависит от природы металла и величины характерного катодного перенапряжения). Но мы-то теперь знаем, каким образом изменять поверхностное натяжение раствора. Можно, к примеру, ввести ПАВ, изменить состав раствора (концентрацию и тип растворённого вещества), изменить температуру, но самое замечательное в том, что мы можем изменять величину (и знак) заряда поверхности металла, изменяя при этом поверхностное натяжение прилегающего раствора на катоде, путём простого изменения величины электрического тока, протекающего через электролизёр! Это даёт нам потрясающий ключ к управлению электрохимическими процессами на электродах! Все перечисленные ухищрения с успехом используются в современной технологии электрохимического осаждения металлов.
мёдом, поверхностным натяжением и зарядом к получению металла из раствора? Что за каша?! – спросите вы. Как оказалось, отношение есть – и самое прямое! Если вы возьмёте два раствора со средней концентрацией растворённого вещества – раствор нитрата серебра (в одном стакане) и раствор сульфата меди (в другом стакане) – и опустите в них одинаковые пластины серебра и меди (соответственно) в качестве анодов, а также графитовые одинаковые пластины в качестве катодов, то получите два небольших электролизёра. Соединив их последовательно по току, пропустим через них некоторое количество электричества. Количество электричества, прошедшее через каждый электролизёр будет, соответственно, одинаковым. Проведя серию простых экспериментов, изменяя значение тока в электролизёрах, вы очень скоро заметите, что на катодной поверхности (катод – отрицательно зараженный электрод) довольно легко получить относительно ровный слой осаждённой меди, а вот в случае с осаждением серебра – ничего у вас не выйдет. Вместо ровного слоя серебра вы получите много бесформенных, неравномерно расположенных дендритообразных кристалликов в виде ветвящихся нитей. Теперь вы видите связь с мёдом? Именно так! Как у нашего мёда в одном случае росли мелкие кристаллы, а в другом – крупные, так и в случае электролиза – кристаллики меди оказались относительно мелкими, а вот кристаллики серебра – существенно больше, почему и не вышло ровного слоя серебра! Как мёд со временем естественно кристаллизуется, так же кристаллизуется при электровыделении из раствора и металл! Процесс выделения металла в виде некоторого плотного осадка на катоде, при пропускании электрического тока через раствор, называется электрокристаллизацией. И закономерности, наблюдаемые при этом, в значительной степени, аналогичны закономерностям обычной кристаллизации! Значит, поверхностное натяжение на поверхности металл-раствор, в нашей попытке осадить серебро из раствора его нитрата, было слишком большим для формирования мелкокристаллического осадка? Точно так! Поэтому ничего и не получилось! (На самом деле закономерность несколько сложнее и сильно зависит от природы металла и величины характерного катодного перенапряжения). Но мы-то теперь знаем, каким образом изменять поверхностное натяжение раствора. Можно, к примеру, ввести ПАВ, изменить состав раствора (концентрацию и тип растворённого вещества), изменить температуру, но самое замечательное в том, что мы можем изменять величину (и знак) заряда поверхности металла, изменяя при этом поверхностное натяжение прилегающего раствора на катоде, путём простого изменения величины электрического тока, протекающего через электролизёр! Это даёт нам потрясающий ключ к управлению электрохимическими процессами на электродах! Все перечисленные ухищрения с успехом используются в современной технологии электрохимического осаждения металлов.